Eric Billy, Franck Clarot, Corinne Depagne, Stéphane Korsia-Meffre, Michaël Rochoy, Florian Zores
Alors que l’épidémie de SARS-COV-2 submerge l’Europe avec une nouvelle vague, le vaccin du laboratoire anglo-suédois AstraZeneca se retrouve sous les feux des projecteurs, soupçonné d’effets indésirables hématologiques graves [1].
Comme tous les médicaments qui comportent des principes actifs, les vaccins font l’objet d’une pharmacovigilance qui vise à identifier la survenue d’effets indésirables et à déterminer s’ils sont en lien (causalité) avec son administration [2]. Les premiers cas de problèmes de coagulation ont été rapportés en Autriche, Italie et dans les pays nordiques. Cela a allumé les signaux d’alerte de pharmacovigilance au sein des pays de l’Union Européenne, et les autorités nationales ont scruté de manière encore plus précise les remontées de problèmes de même nature [1,3]. La décision de l’Allemagne de suspendre suite à 7 cas rapportés pour 1,5 millions de personnes vaccinées a, par effet de domino et de synchronicité européenne, poussé la France a également suspendre le vaccin dans l’attente d’une analyse poussée des cas graves rapportés dans l’ensemble de l’Europe. L’Organisation Mondiale de la Santé (OMS) et l’European Medicines Agency (EMA, agence européenne du médicament) ont rapidement précisé que la balance bénéfices-risques restait en faveur du vaccin [1,3,4].
Pour remettre ces données en perspective, sur la base des données allemandes, avec un fréquence 1/200,000 pour cet effet indésirable thrombotique, le coût humain d’un échantillon de 1,5 millions de personne infectées du fait d’une non vaccination serait de 1500 décès avec un létalité de 0,1% (1/1000).
C’est la décision allemande qui a été l’élément déclencheur de la suspension du vaccin AstraZeneca, suite à un avis de l’Institut Fédéral des Vaccins et Biomedicines Paul Ehrlich [5] et à la remontée d’un nombre inhabituel de thrombose des sinus veineux cérébraux associées à une déficience plaquettaire (thrombocytopénie) et des hémorragies. Cette association a été retrouvée dans sept cas (au 15 mars 2021, date de la suspension en Allemagne), et une association chronologique compatible avec la vaccination avec le vaccin COVID-19 de AstraZeneca a été pointée [5]. Les personnes touchées sont toutes des femmes âgées de 20 à 50 ans. Six sur sept ont présenté une thrombose des sinus veineux cérébraux, survenue 4 à 16 jours suivant la vaccination, et chez les sept patientes atteintes, trois sont décédées [5]. C’est donc la survenue de formes similaires de thromboses rares au sein d’une population d’âge normalement peu touchée, avec une fréquence supérieure à la population générale, qui a mené l’institut Paul Ehrlich à recommander la suspension du vaccin AstraZeneca par mesure de précaution dans l’attente de la révision par le PRAC (Pharmacovigilance Risk Assessment Committee) de l’EMA rendue le 18 mars [4].
Qu’en est-il en France ?
En France, sur la période considérée jusqu’au 4 mars, 454 545 personnes ont reçu le vaccin AstraZeneca [6] (les effets indésirables suspects survenus après l’administration sont déclarés par les médecins ou les patients aux centres régionaux de pharmacovigilance, qui les font ensuite remonter à l’Agence Nationale de Sécurité du Médicament et des produits de santé [7]).
Parmi les effets hématologiques, 10 cas ont été enregistrés dont 3 ont été jugés graves :
- L’un d’eux dans un contexte de CIVD (coagulation intra vasculaire disséminée) compliquée de thromboses multiples faisant évoquer un syndrome majeur des antiphospholipides (SAPL), sans mise en évidence à ce jour d’anticorps, et dont l’état clinique est en cours d’amélioration
- Les deux autres cas en rapport avec des lymphadénopathies (anomalie des lignées blanches), l’un dans un contexte de syndrome pseudo-grippal, l’autre associé à des vertiges, vomissements, myalgies, asthénie et désaturation
Les sept cas non graves mentionnent également des lymphadénopathies dans un contexte de syndrome pseudo-grippal.
En France, il n’existait donc au 12 mars qu’un seul cas de CIVD déclaré aux centres de pharmacovigilance sur quelque 450 000 vaccinations. Compte tenu de sa gravité et de l’existence de cas autrichiens de thromboses multiples ayant conduit à la suspension du lot ABV5300, l’ANSM a initialement considéré qu’il y avait un signal à étudier sur les cas de coagulopathies [6]. Le 8 mars, elle a indiqué l’existence d’un signal européen en cours d’investigation sur les thrombocytopénies et des cas avec thromboses multiples [1]. L’ANSM a également proposé d’ajouter les critères de pathologie de la coagulation et de SAPL dans la requête européenne, car certaines thrombopénies secondaires n’étaient pas codées comme telles, et ne semblaient pas ressortir dans les bases de pharmacovigilance.
Le 18 mars 2021, l’EMA a rendu ses conclusions : en Europe, 7 cas de CIVD post-vaccination ont été signalés et 18 cas de thromboses des sinus veineux cérébraux, ainsi qu’un nombre non communiqué de thrombopénie. Ces cas ont, comme en Allemagne, essentiellement concerné des femmes plutôt jeunes et il n’y avait pas de relation de cause à effet démontrée à l’heure actuelle [4,8]. L’institut Paul Ehrlich a aussi conclu le 19 mars 2021 “qu’il n’y a aucune preuve d’un défaut de qualité (c’est-à-dire une association de lots spécifiques ou de fabrication sur des sites spécifiques du vaccin avec les événements thromboemboliques observés)” et “aucune preuve que la survenue de ces troubles de la coagulation ait été causée par le vaccin” [9].
Quelles peuvent être les causes de ces thromboses ?
Les causes de thromboses sont multiples et peuvent survenir quasiment à tout âge en fonction de comorbidités ou de facteurs génétiques [10] :
- cancers
- traumatismes
- sepsis, infections virales/bactériennes (dont COVID-19)
- post-partum /post abortum
- contexte post-opératoire, alitement prolongé
- consommation de toxiques
- autres causes, dont des maladies génétiques, auto-immunes, ou des associations de risque (contraceptifs oestroprogestatifs + tabac)
Ainsi, la survenue de thrombose peut être liée à un ou plusieurs de ces facteurs, et être concomitante à la vaccination, dans le cadre d’une campagne de masse en période de pandémie. Néanmoins, afin d’étayer l’hypothèse de causalité entre la vaccination et la survenue des évènements thrombotiques, nous proposons une hypothèse physiopathologique.
La piste des polynucléaires neutrophiles, du NET (Neutrophil extracellular traps), des plaquettes et de l’immunité innée.
Le vaccin AstraZeneca est basé sur un adénovirus exprimant la protéine S du SARS-CoV-2, qui permet l’établissement d’une réponse immunitaire humorale et cellulaire contre le virus. Lors d’une infection virale, et en particulier dans le cas du SARS-CoV-2, l’une des réponses du système immunitaire inné (non sélective, mais pouvant être activée immédiatement) est la production par les polynucléaires neutrophiles d’un maillage dit “NET” (Neutrophil extracellular traps) pouvant s’apparenter à un filet, et dont l’objectif est “d’attraper” et “d’emprisonner” les virus circulants.
Si le NET peut être utile et efficace, en cas de dysrégulation, il peut être néfaste, comme de multiples études l’ont montré, notamment dans la COVID-19, car le NET peut être associé à la survenue de thromboses [11–13].
De plus, tous les cas français relevant d’effets indésirables hématologiques ont présenté une lymphadénopathie, en faveur d’une réaction immunitaire ; et cela a aussi été observé chez au moins 3 patients norvégiens, dont les paramètres sanguins évoquaient une réaction immunitaire intense.
L’une des hypothèses pouvant expliquer la survenue de thrombose par activation anormale du NET, suite à l’injection vaccinale, est l’injection accidentelle du vaccin dans une veine au sein du deltoïde. Les adénovirus seraient alors injectés directement dans le sang, ce qui engendrerait une réponse immunitaire innée et adaptative, l’activation des neutrophiles et le relargage de NET. Puis la formation de thrombus définirait la gravité des thromboses.
Le passage intraveineux : une hypothèse possible, selon la littérature ?
L’adénovirus comme de nombreux autres virus (rétrovirus, lentivirus, AAV) est beaucoup utilisé en recherche comme vecteur soit pour étudier certains gènes, soit pour les apporter à des cellules, in vitro ou in vivo [14]. Dans ce dernier cas, l’injection des virus dans les modèles de souris a donné lieu à de nombreuses publications concernant la pharmacocinétique / pharmacodynamique de ces virus en fonction des voies d’administration. Une récente publication fait le point sur la réponse immunitaire induite par l’injection intraveineuse d’adénovirus dans la souris : elle montre que l’adénovirus administré en IV disparaît très rapidement de la circulation sanguine et est indétectable après 30 minutes [14].
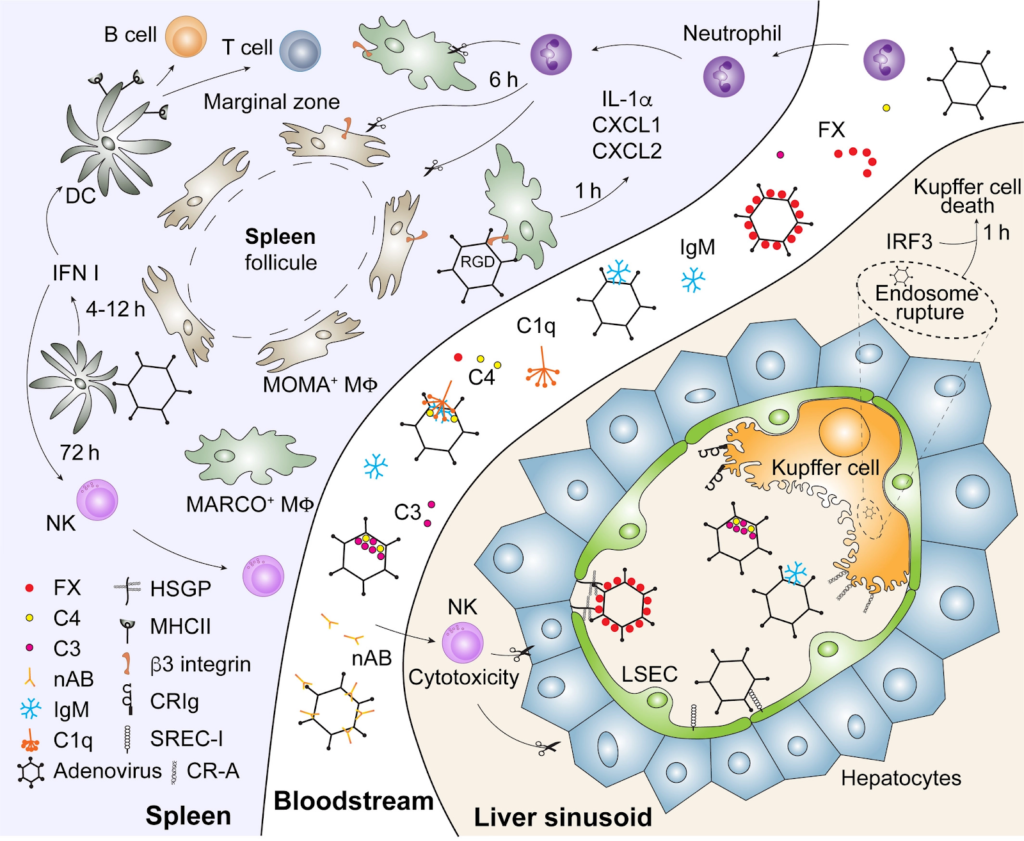
Cela ne correspond pas à son élimination mais à son piégeage. Quand il s’agit de grande quantité de particules virales, cette administration intraveineuse peut être létale pour la souris mais également chez le primate non humain [15].
En effet, si la quantité de virus est trop importante, les différents mécanismes de captures par le système immunitaire inné peuvent engendrer une capture hépatique et un “orage inflammatoire” avec choc cytokinique, activation de la cascade de la coagulation, susceptible d’aboutir à une thrombocytopénie de consommation, une CIVD, et une atteinte multiviscérale pouvant mettre en danger la souris, ou la tuer [14].
Les quantités de virus utilisées pour obtenir cet effet toxique chez la souris sont de l’ordre de plus de ~50 milliards de particules virales pour un animal de 20g (2500 milliards de virus/kg). Par comparaison, le vaccin d’AstraZeneca contient 50 milliards d’adénovirus (soit 0,7 milliard de virus/kg pour un humain de 70 kg, soit un rapport 35 000 fois inférieur à celui de la souris) [16]. Même si la comparaison avec animal peut être discutée, et que des thromboses induites par des adénovirus injectés chez l’homme sont rapportées dans la littérature [17,18], il existe une discordance très significative de doses, rapportées au vaccin ; cette réaction pourrait donc uniquement contribuer à un mécanisme spécifique et rare, plutôt que d’en être totalement responsable, en “allumant la mèche”.
Dans une récente publication, des chercheurs ont montré que la protéine Spike du SARS-CoV-2 et du coronavirus OC-43 sont des activateurs du système du complément et peuvent induire une cascade immunitaire conduisant à des thromboses [19]. Dans le cas du vaccin cela pourrait être lié à la capture de l’adénovirus par les chaînes d’héparan sulfate situées à la surface des cellules endothéliales et à l’action directe du complément. La réaction du complément pourrait également être associée à une réaction humorale auto-immune, du fait d’un mimétisme antigénique entre des épitopes adénoviraux et des épitopes du soi comme c’est le cas dans thrombopénie induite par l’héparine de type 2 où le corps produit des anticorps reconnaissant le complexe héparine-PF4 comme étranger. Cet anticorps va alors à son tour activer les plaquettes et engendrer une thrombocytopénie spécifique (TIH). Cela pourrait également être lié aux anti-phospholipides responsables de syndrome antiphospholipide (SAPL) primaire ou secondaire déjà mis en évidence pour le SARS-CoV-2 [20]. Le délai de production de ces autoanticorps expliquerait la survenue des événements indésirables dans un intervalle de 4-14 jours après l’injection, comme dans la thrombopénie induite par l’héparine de type 2 [21].
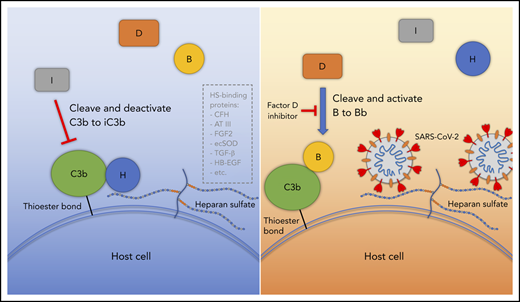
Yu et al. Blood (2020) 136 (18): 2080–2089. https://doi.org/10.1182/blood.2020008248
Un autre facteur potentiellement impliqué pourrait être l’expression de la protéine Spike par les cellules endothéliales infectées par l’adénovirus à la suite d’une injection intraveineuse accidentelle du vaccin. En effet, le Spike se liant à l’ACE2 (enzyme de conversion de l’angiotensine de type 2), l’enzyme pourrait être piégée au niveau intracellulaire, empêchant ainsi une présence à concentration normale d’ACE2 à la surface des cellules. Cette absence ou réduction d’ACE2 membranaire pourrait engendrer une augmentation du risque thrombotique [22].
La différence de population vaccinée entre l’Europe et le Royaume-Uni peut également donner des pistes supplémentaires. Au Royaume-Uni, ce sont essentiellement des personnes âgées de 50 ans et plus qui ont été vaccinées alors qu’en Europe c’est plutôt une population de 50 ans et moins. Cette observation pourrait pointer vers un rôle de l’intensité de la réponse vaccinale dans la survenue des ces formes rares de thrombose. Enfin, il est possible que l’utilisation de contraceptifs estroprogestatifs chez les femmes de moins de 50 ans et/ou le tabagisme soient des facteurs aggravant.
Au cours des derniers jours, le centre médical universitaire de Greifswald a examiné des échantillons de sang de sept patients, en étroite coopération avec l’Institut Paul Ehrlich, qui est responsable du test des vaccins, en Allemagne, et en association avec les cliniques universitaires de Graz et de Vienne. Un peu comme dans la TIH, il semble que des anticorps se forment contre un complexe d’héparine et de la molécule de signalisation PF4, qui à leur tour interagissent avec le récepteur CD32 des plaquettes et les activent. Cela déclenche la cascade de coagulation qui conduit à la thrombose. Les anticorps formés chez les personnes vaccinées étaient très similaires à ceux qui se produisent avec dans la TIH [23,24].
Ainsi, l’une des hypothèses liant le vaccin à la survenue de thrombose grave pourrait être une injection intraveineuse accidentelle qui, en présence de facteurs non intégralement identifiés, engendrerait une réaction immunitaire discordante avec activation des plaquettes, potentiellement associé à un effet NET ou à une diminution du taux d’ACE2 à la surface des cellules endothéliales, conduisant à un sur-risque thrombotique.
Un moyen simple de pallier cette hypothétique injection intravasculaire accidentelle pourrait être de vérifier l’absence de retour sanguin lors de la vaccination, ce que ne recommande actuellement pas le ministère de la santé [25].
RÉFÉRENCES BIBLIOGRAPHIQUES
[5] Paul-Ehrlich-Institut. FAQ – Temporary suspension of COVID-19 vaccine AstraZeneca 2021.