Avec la mise à disposition de documents de l’essai clinique de Phase III du vaccin PFIZER-BIONTECH COVID-19 (BNT162, PF-07302048) auprès de la FDA, et qui ont été rendus public, il nous est apparu opportun de faire une analyse des points importants, de la balance bénéfices/risques et des questions demeurant en suspens.
Les documents en version résumée ou complète sont disponibles à la fin de cet article.
Caractéristiques de la population de l’étude
Pour commencer, la population de volontaires comportait des critères d’exclusion :
- moins de 16 ans
- femmes enceintes
- patients ayant fait une COVID (mais pas de sérologie obligatoire avant l’entrée dans l’étude), donc les volontaires ayant fait une forme asymptomatique non détectée n’ont pas pu être exclus


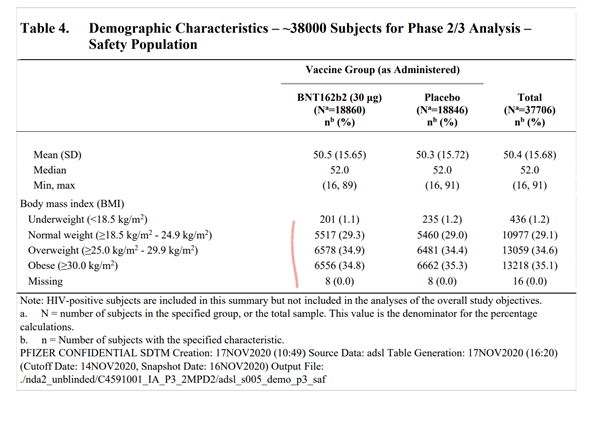
Les informations concernant la répartition de la population sont données dans le tableau 4. On y voit clairement que la proportion de personnes ayant une comorbidité par surpoids est effectivement de ~35% dans les deux groupe. Les autres comorbidités ne sont pas renseignées. La répartition par classe d’âge est de ~60% pour les 16-55 ans et 40% pour les plus de 55 ans. La proportion des personnes âgées (65-85 ans) est réduite, 3848 pour le groupe vaccin et 3880 pour le groupe placebo.
Tolérance et sûreté du vaccin
Pfizer/BioNTech a demandé à un sous-groupe de 8183 participants de porter attention à l’ensemble des symptômes survenant dans les 7 jours suivant l’injection de la première ou de la seconde dose du vaccin (ou du placebo) afin d’étudier en détails la réactogénicité du vaccin et du placebo. Cela définit donc un sous-groupe de personnes qui ont été sollicitées pour remonter des symptômes, à la différence du reste de la population de l’essai qui a indiqué les effets secondaires de manière volontaire, en suivant les gradations et définitions de la FDA.
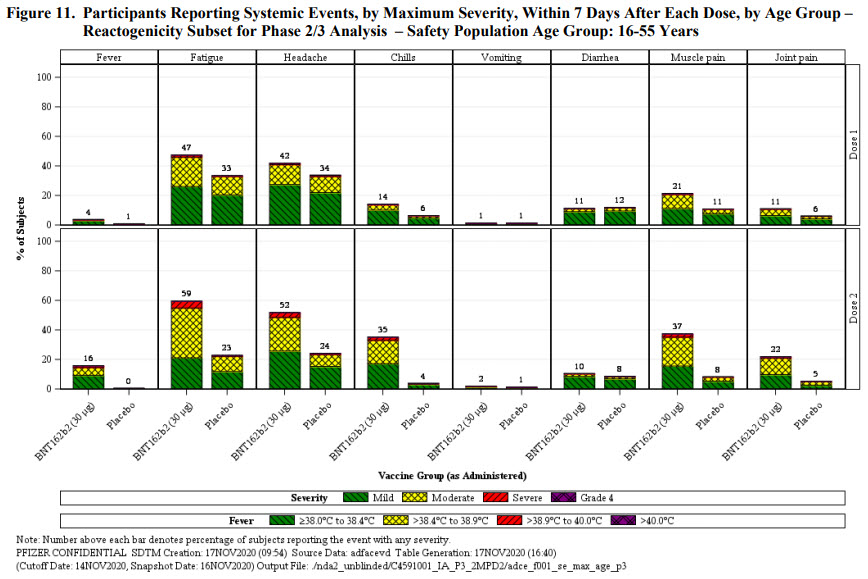
Les participants du groupe réactogénicité ayant reçu le vaccin rapportaient une douleur au point d’injection dans 66-83% des cas contre 8-14% pour le groupe placebo, en fonction des doses et de la classe d’âge. La survenue de cette douleur était moins fréquente chez les patients de + de 55 ans, et moins fréquente dans les deux groupes et les classes d’âge lors de la seconde injection. Cette douleur est donc ~6x plus fréquente chez les personnes vaccinées que chez celles qui ont reçu le placebo et témoigne très certainement d’une réaction inflammatoire locale et de l’initiation d’une réponse immunitaire.
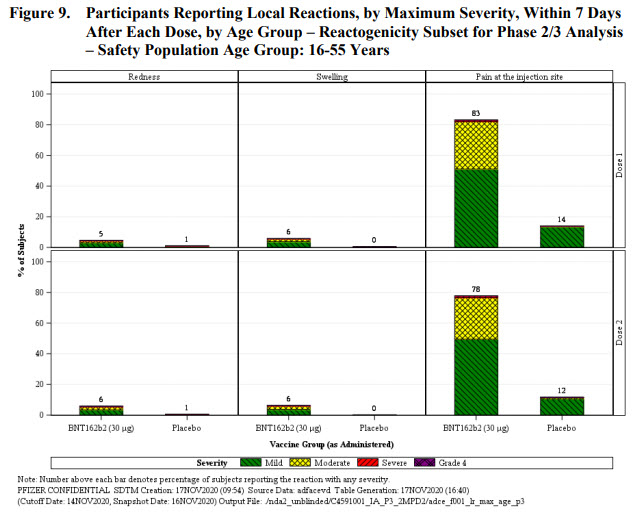
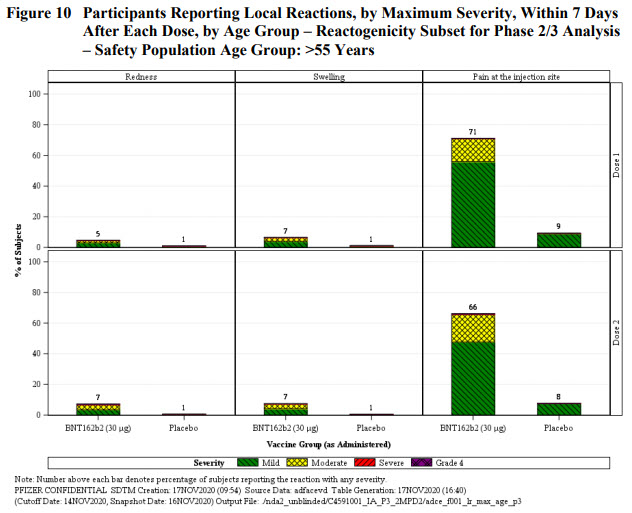
Les rougeurs et gonflements autour du point d’injection ne sont que très rarement rapportés parmi l’ensemble des groupes et classe d’âge. Là aussi une différence de 6x entre le groupe vaccin (5-7%) et le groupe placebo (0-1%).
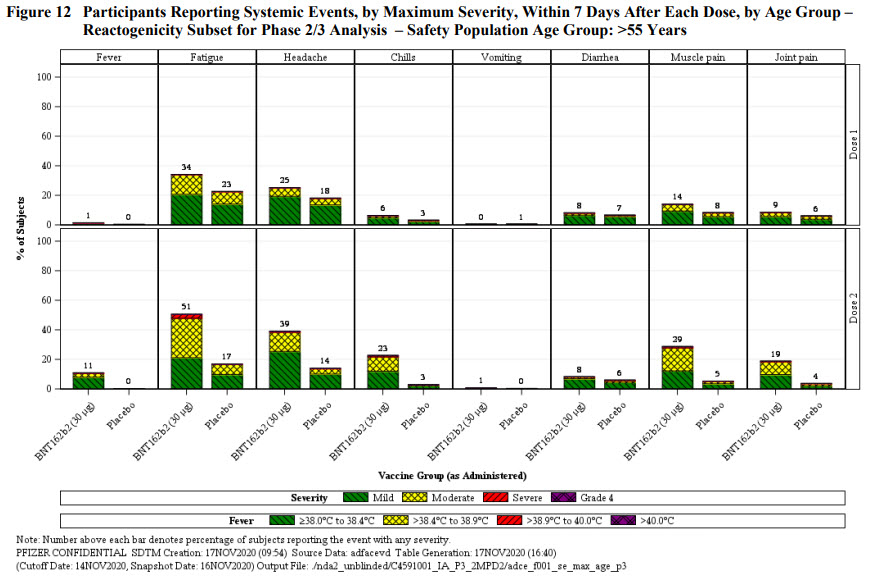
Les deux figures ci-dessous résument l’ensemble des autres effets systémiques (à l’inverse de ceux localisés) enregistrés chez les participants. Il est fréquent que surviennent fatigue, maux de tête, douleurs musculaires, frissons, fièvre (rarement à plus de 39°C). Réaction normale après vaccination et qui reflète la mise en route du système immunitaire. La vraie incidence est toujours issue de la comparaison avec le groupe placebo. 42% de maux de tête pour le groupe vacciné vs. 34% pour le groupe placebo. La part pouvant être attribuée aux composants du vaccin c’est donc la différence entre ces deux chiffres. Il n’y a rien de surprenant d’avoir plus d’effets secondaires dans le groupe vacciné que dans le groupe placebo.
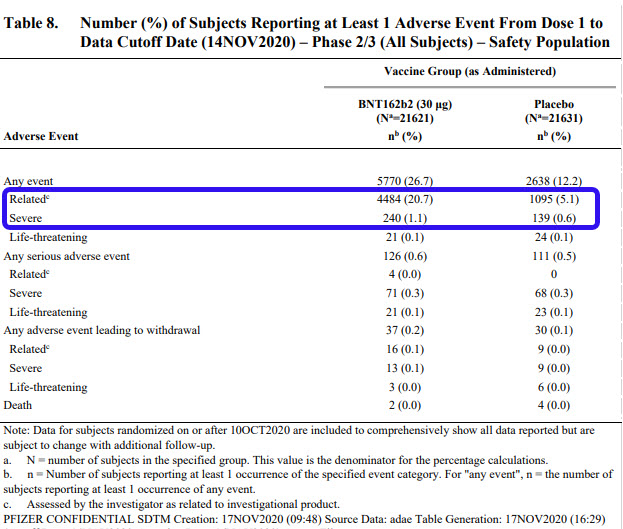
Si on considère maintenant l’ensemble des participants et qu’on inclut les effets secondaires sollicités et ceux remontés volontairement, on obtient le tableau suivant. On a donc une augmentation de ~4x de l’incidence d’effets indésirables liés au vaccin, et aucun cas grave ayant pu être mis en relation avec le vaccin.
Les effets secondaires dans le groupe vaccin sont avant tout liés… à l’injection en elle-même. Donc aucune inquiétude à nouveau, c’est explicable et normal, ça dure 2 à 3 jours et ça passe. Il y a eu quelques adénopathies (augmentation de la taille des ganglions) au niveau du bras et du cou, qui ont duré une dizaine de jours. Les ganglions étant le refuge de vos globules blancs, rien de grave encore une fois, ca fait partie de la mise en place d’une réaction immunitaire, lors d’infections bénignes les enfants ont souvent des ganglions maxillaires gonflés.
Vous avez dû voir passer une histoire d’appendicites. Il y a un peu plus (8 vs 4) d’appendicites dans le groupe vacciné, sur 40.000 patients. Cette différence est probablement purement due au hasard. On surveillera les mois qui viennent les services de chirurgie digestive.
Donc comme tout vaccin il peut (c’est fréquent mais pas obligatoire) entraîner des symptômes dits de type « grippaux » post injection, ce qui n’est d’aucune gravité. C’est le cas pour d’autres vaccins par exemple celui de la grippe : https://www.ncbi.nlm.nih.gov/pmc/articles/PMC5861790/
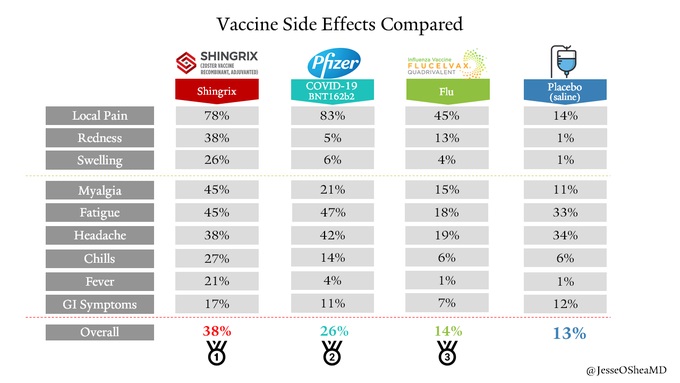
Donc au final, un vaccin avec un profil de tolérance sans surprise, similaire à celui de plein d’autres vaccins (voir ci-dessous les graphes comparatifs avec l’incidence des effets secondaires d’autres vaccins). Il faudra évidemment poursuivre la surveillance dans les mois qui viennent, mais il n’y a aucun signal inquiétant, c’est maintenant du ressort de la phase IV : la pharmacovigilance.
Le vaccin permet donc de fortement diminuer le risque de développer la maladie. Il n’y a (quasiment) jamais de 100 ou de 0% en médecine. Il peut y avoir un risque résiduel, car développer la maladie est également un processus biologique multifactoriel et dépendra du « terrain » de la personne infectée. Les études sont là pour quantifier ce risque et pour guider au mieux l’utilisation du vaccin. Ci-dessous un comparatif des effets indésirables de plusieurs vaccins comparés au placebo.



Informations manquantes dans cette étude:
- Les patients à risques sont sous-représentés. Certes l’effet est consistant dans tous les sous-groupes (et vous savez ce qu’on en fait des analyses de sous-groupe) ; mais les plus âgés sont très peu nombreux, de même que les patients avec comorbidités ne représentent que 40%. En fait la population étudiée est à l’image de la population américaine dans l’incidence du surpoids et des classes d’âge. Les plus de 65 ans ne représentent que 20% des participants, alors qu’ils comptent pour plus de 80% des décès dans la plupart des pays développés.
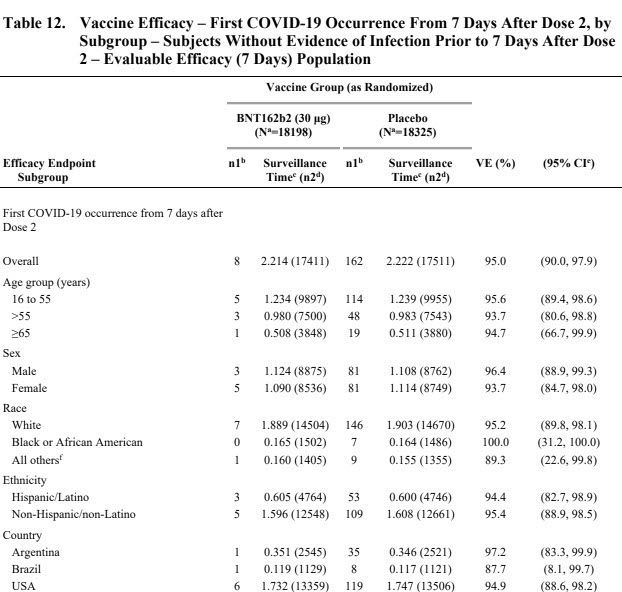
- On sait que les plus âgés répondent moins bien à la vaccination que les plus jeunes, en raison du vieillissement du système immunitaire. D’ailleurs leur réponse au vaccin est un peu moins bonne (rapide et profonde) que les sujets jeunes.
- Les formes graves sont trop peu nombreuses pour qu’on puisse conclure sur l’effet du vaccin sur les formes graves. Cela va de pair avec la sous-représentation des patients à risques. Alors évidement, en diminuant le nombre de COVID symptomatiques, on diminuera mécaniquement le nombre de formes graves. Mais on ne sait pas si le vaccin diminue le risque de faire une forme grave chez un patient qui ferait une COVID malgré le vaccin. La question de débuter la vaccination par les plus âgés (qui ne sont pas dans l’étude) pour les protéger des formes graves (pour lesquelles on n’a pas la réponse) est donc à discuter. (Rappel : l’absence de preuve n’est pas la preuve de l’absence. Le vaccin diminue peut être les formes graves, mais on ne peut pas conclure car on n’a pas assez de patients).
- Le dernier GROS point d’interrogation : la contagiosité. Le vaccin diminue-t-il la contagiosité ? Peut-être, ou pas. On n’en sait rien, ça n’a pas été étudié. Il faut donc considérer (tant qu’on n’a pas d’étude) qu’un sujet vacciné peut être contagieux s’il inhale le virus. Il est protégé lui, mais ne protège pas les autres. Donc à l’heure actuelle, être vacciné (avec le vaccin Pfizer) ne dispense pas du masque et des mesures barrières. Sinon l’épidémie risque de continuer de se propager jusqu’à ce que l’immunité de population soit atteinte (au moins 60% de la population).
Qu’en est-il de l’immunité induite par le vaccin?
Les données communiquées par Pfizer indiquent que la réponse immunitaire induite est humorale ET cellulaire. C’est une excellente nouvelle.
La figure ci-dessous montre le niveau de la réponse cellulaire chez des patients post COVID (donc réponse induite par la maladie, HC, entourée en orange) et celle induite par différents dosages du vaccin (7 jours après la deuxième dose : 1ug, 10ug, 20ug, 30ug). On obtient une réponse cellulaire 4 à 10 fois supérieure grâce au vaccin (30ug): 0.25 vs. 0.02 pour les lymphocyte T CD8+ (cytotoxique). Cette réponse cellulaire est dirigée uniquement contre la partie N-Terminal (proximale) de la protéine S du virus, couvert par le pool de peptide de stimulation S1.
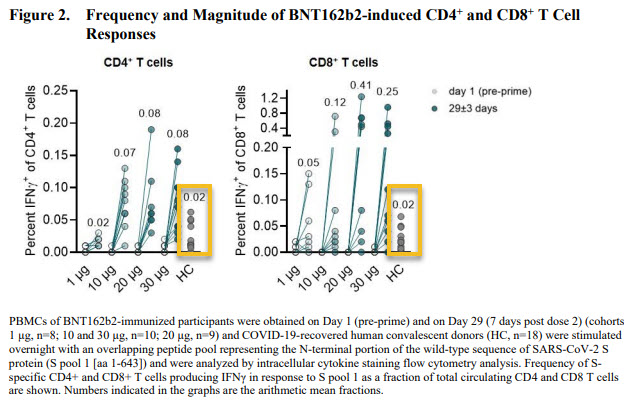
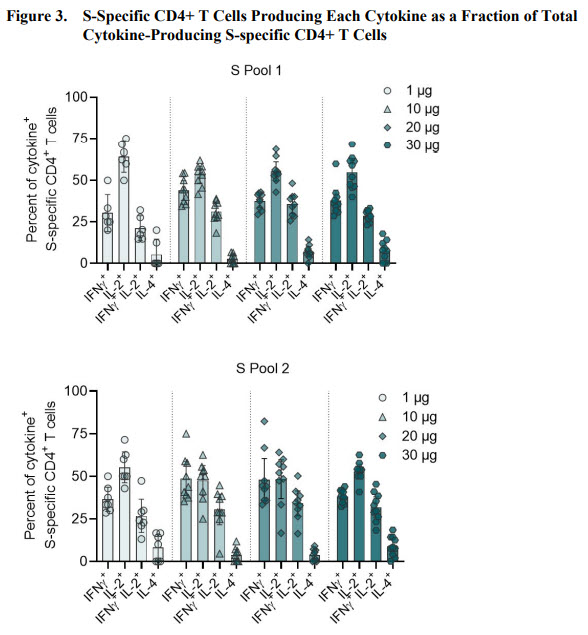
Ils ont donc voulu regarder si l’ensemble de la protéine S pouvait être la cible de la réponse cellulaire (voir figure ci-dessous). On voit que le pool S2 couvrant la seconde partie de la protéine S induit également la production de cytokine par les lymphocytes T CD4+, et cela dans des proportions similaires au pool S1.
Pfizer/BioNTech indique que la réponse cellulaire CD8+ était détectée chez ~85% des personnes vaccinées, chiffre similaire pour les CD4+. On peut regretter que cette étude de la réponse cellulaire n’ait été faite que sur un échantillon assez faible (37 volontaires).
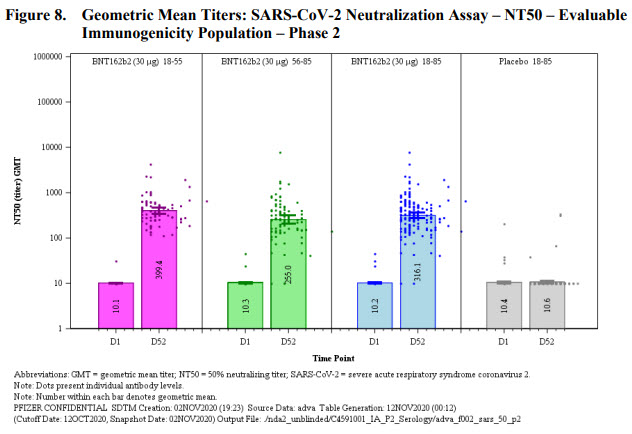
Pour la réponse humorale, on obtient des taux d’anticorps neutralisants équivalents ou supérieurs à ceux détectés chez des patients COVID (HCS). Les titres chutent un peu en fonction du nombre de jours après la dernière dose évaluée (50 jours).
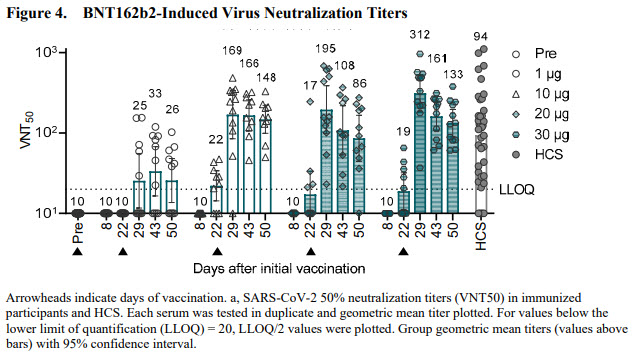
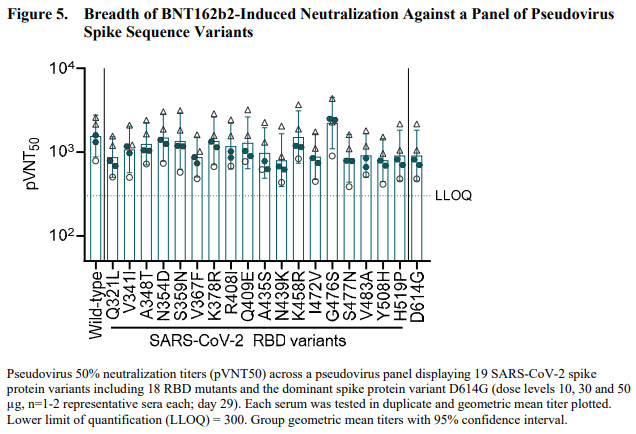
Ils ont également étudié la capacité des anticorps induits par le vaccin à inactiver l’infection de cellules par 18 variants RBD du SARS-CoV2, en utilisant le virus Wuhan initial et le variant dominant D614G (variant S non RBD). La réponse induite par le vaccin est capable de neutraliser tous les variants testés, ce qui indique que la pluralité des épitopes ciblés par les anticorps sur la protéine S est capable de compenser les mutations survenues parmi les variants testés.
Conclusions :
- Vaccin très efficace pour réduire la probabilité de faire une COVID symptomatique.
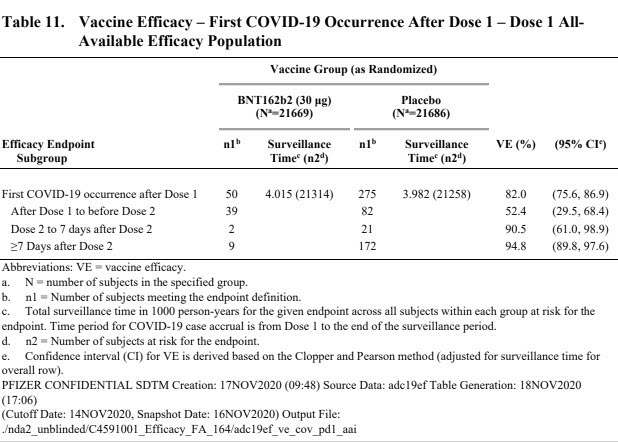
- L’efficacité est équivalente dans tous les sous-groupes testés
- Réaction marquée fréquente aux injections : douleur, syndrome grippal, fièvre. Expliquer et rassurer.
- Pas d’effet secondaire manifeste (on surveillera de loin les appendicites).
- Cette étude ne concerne pas les moins de 16 ans ni les femmes enceintes ou allaitantes.
- Peu de données sur les plus de 65 ans.
- On ne peut pas conclure sur une protection vis-à-vis des formes graves car les effectifs sont insuffisants.
- Aucune info sur une éventuelle diminution de contagiosité : Quid des patients ayant déjà fait une COVID ?
- Vous avez vu passer cette courbe déjà des dizaines de fois, qui montre que les cas de COVID sont plus fréquents dans le groupe placebo.
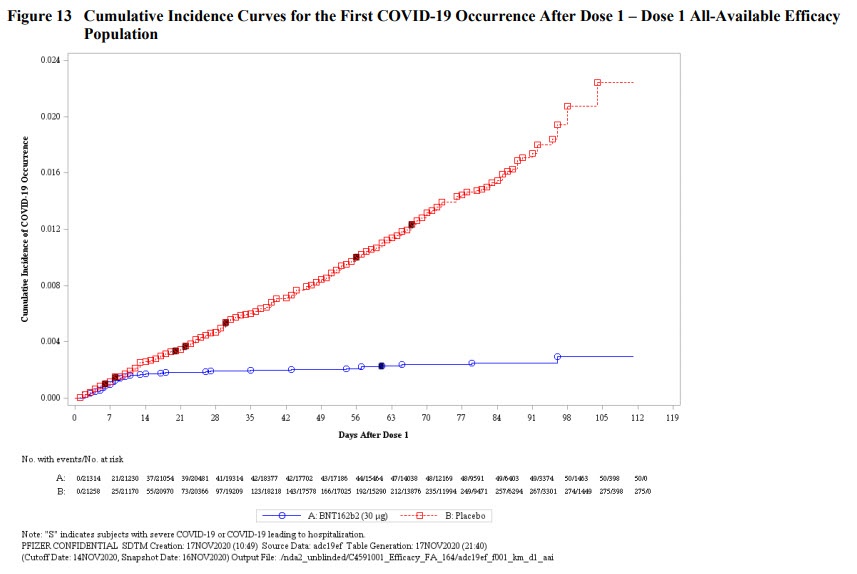
Quelques remarques complémentaires par rapport à cette courbe d’incidence cumulative :
- L’efficacité apparait dès la première injection mais est majorée par la deuxième.
- Les 2 doses étant espacées de 21 jours, on voit que la première dose est déjà efficace au bout de 10 jours.
- Une dose ne suffit pas à procurer une protection suffisante, mais c’est déjà ça de pris.
- Les cas graves sont majoritairement dans le groupe placebo : la possibilité que le vaccin favorise des formes graves notamment chez des patients ayant fait une COVID semble inexistante.
En attendant de pouvoir comparer avec les autres vaccins anti SARS-CoV2 à venir.
Florian Zores et Eric Billy
MRNA-1273 SPONSOR BRIEFING DOCUMENT: https://www.fda.gov/media/144452/download
FDA Briefing Document Moderna COVID-19 Vaccine: https://www.fda.gov/media/144434/download
